Zellmigration
Dendritische Zellen lösen eine erworbene Immunantwort gegen Krankheitserreger und Tumorzellen aus
Dendritische Zellen sind antigenpräsentierende Immunzellen, die das Gewebe aktiv nach Krankheitserregern durchsuchen. Sobald sie zum Beispiel Viren oder Bakterien entdeckt und aufgenommen haben, werden sie sehr mobil und produzieren in ihrer Zellmembran den Chemokin-Rezeptor CCR7, welcher spezifisch die beiden Chemokine CCL19 und CCL21 erkennt. Die beiden Lockstoffe lösen bei den Dendritischen Zellen eine gerichtete Wanderungsbewegung, Chemotaxis genannt, aus und führen sie durch das Gewebe hindurch zu den Lymphgefässen und schliesslich in die nächstgelegene Lymphdrüse. Dort angekommen, starten die Dendritischen Zellen eine massgeschneiderte erworbene Immunabwehr, indem sie anderen Immunzellen, den T Zellen, Bruchstücke (Antigene) des zuvor aufgenommenen Krankheitserregers auf ihrer Oberfläche präsentieren.
Die koordinierte Zellwanderung spielt bei der spezifischen Immunabwehr gegen Krankheitserreger oder Krebs eine zentrale Rolle. Unterschiedliche Signale, die zur Aktivierung und Migration der Immunzellen führen, bestimmen die Wirksamkeit der ausgelösten Immunantwort. Wir erforschen im Labor die molekularen Mechanismen, mit welchen verschiedene Immunzellen Botenstoffe erkennen, um nach dem Kontakt mit Letzteren zielstrebig wandern zu können.
Um die Wanderungseigenschaften von CCR7 exprimierenden Zellen in Raum und Zeit vertieft mikroskopisch in Echtzeit analysieren zu können, verwenden wir einen 3D Kollagenmatrix-Migrationstest. Mit dieser Methode analysieren wir die Wanderung der Zellen in einem physiologischen dreidimensionalen Netzwerk von Kollagenfasern in Richtung steigender CCL19- oder CCL21- Konzentration. Wir konnten dank selber hergestellter fluoreszierender Chemokine beobachten, dass in diesem System CCL19 und CCL21 unterschiedliche Ausprägungen der Bildung eines Chemokingradienten erreichen (Abbildung 1), was mit der Effizienz der Chemotaxis von humanen Dendritischen Zellen korrelierte. Unmittelbar nach Zugabe von rot fluoreszierendem CCL19-S6Dy549P1 in das an die Kollagenmatrix mit den eingebetteten Dendritischen Zellen angrenzende Reservoir war das fluoreszierende Signal sehr hoch, nahm über die ersten hundert Mikrometer der 3D Kollagenmatrix rapide ab und erstreckte sich während der Messzeit über die ganze Matrix. Demgegenüber konnte CCL21-S6Dy549P1 während der ersten 300 Minuten nur über eine kurze Distanz in die Matrix eindringen und das Fluoreszenzsignal nahm mit zunehmender Distanz zum Chemokinreservoir steil ab.
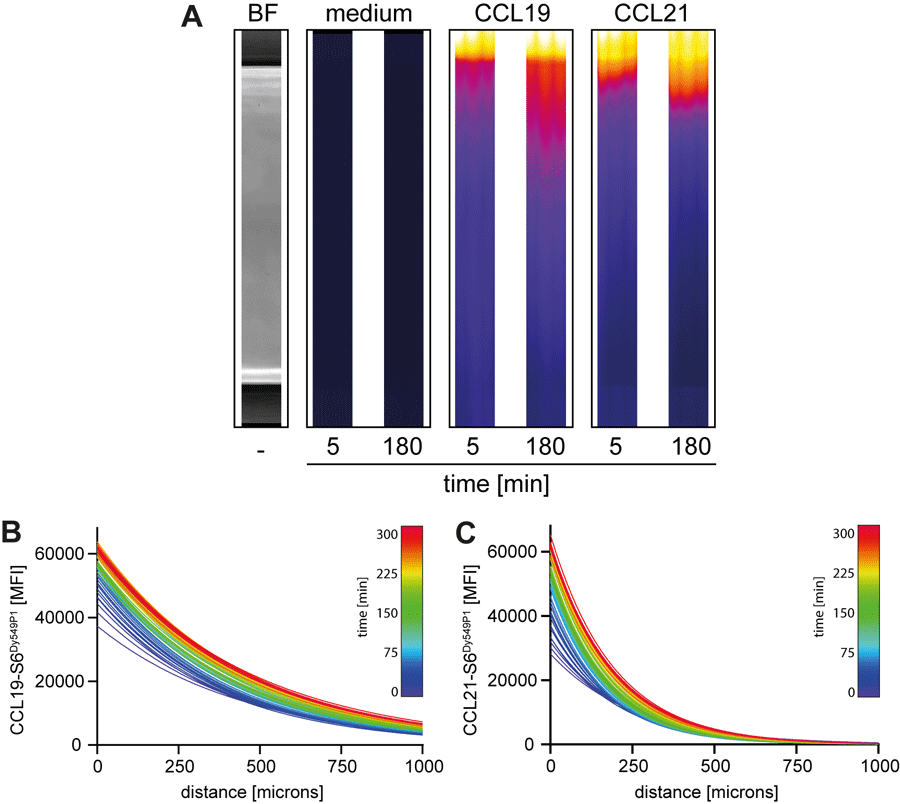
Abbildung 1: Unterschiedliche Erscheinungsform von CCL19- und CCL21-Chemokingradienten. (A) Mikroskopbilder eines Ausschnitts der 3D Kollagenmatrix-Kammern für die Beobachtung von migrierenden humanen Dendritischen Zellen. Hellfeld-Mikroskopiebild (BF, Bright field) sowie Fluoreszenzbilder ohne Zugabe von Chemokin (nur Zell-Medium) respektive mit Zugabe von fluoreszierendem (S6Dy549P1 gekoppeltem) Chemokin zum Zeitpunkt der Applikation (t=0 min; Chemokinquelle am oberen Bildrand) und 180 Minuten später nach der Verteilung der Moleküle in der Gelmatrix. Die Distanz über die gesamte Gelmatrix beträgt 1mm. (B-C) Verteilung der S6Dy549P1 gekoppelten CCL19 respektive CCL21 Moleküle in den Kollagenmatrix-Kammern. Die mittlere Fluoreszenz-Intensität (MFI) der in die Matrix diffundierenden Chemokine wurde in der 3D Matrix für 5 Stunden mikroskopisch bestimmt und mit einem "one-phase decay model" farbig dargestellt: blau (t = 0min) bis rot (t = 300min). [Figur modifiziert aus Artinger, M. et al. (2022) Front Immunol, open-access Artikel (CC BY)].
Ein wichtiges Ziel unserer Forschung ist es, neue Moleküle und Signalwege zu entdecken, um die Chemotaxis und die Aktivierung von Immunzellen gezielt verändern zu können. So haben wir zum Beispiel herausgefunden, dass der Entzündungsmediator Prostaglandin E2 die Aktivierung von Dendritischen Zellen massgeblich mitbestimmt und einen entscheidenden Einfluss auf ihre Chemotaxis und den Erfolg der spezifischen Immunantwort ausübt.
Im Lauf der letzten Jahre haben wir erstmalig eine gegen CCL19 (Video 1) und CCL21 wandernde humane Dendritische Zelllinie sowie ein Modell zur Herstellung von immortalisierten (unsterblichen) Vorläuferzellen von Dendritischen Zellen, welche aus dem Knochenmark abgeleitet sind (sogenannte BMDCs, bone marrow-derived dendritic cells), entwickelt. Diese Zellen lassen sich, im Gegensatz zu Primären Zellkulturen, welche direkt aus einem Organ oder Gewebe isoliert und gezüchtet werden, genetisch leicht manipulieren.
So sind wir nun in der Lage, spatio-temporale Signalübertragungswege dank einer Reihe von in unserem Labor entwickelten fluoreszierenden Biosensoren oder Signalproteinen nicht nur in etablierten Krebszelllinien, sondern auch in wandernden Dendritischen Zellen "live" zu beobachten.
Video 1: Nachweis der Anreicherung des grün fluoreszierenden PIP3-Biosensors PH-Akt-GFP an der Zellfront migrierender CAL-1 Zellen. Genmanipulierte CAL-1 Zellen, welche stabil PH-Akt-GFP exprimieren, wurden für drei Tage mit dem Botenstoff GM-CSF differenziert und anschliessend für 18 Stunden mit dem synthetischen Toll-Like Rezeptor TLR7-Liganden Resiquimod (R848) gereift. Die Wanderung der Zellen in einem CCL19-Gradienten im 3D-Kollagen-Matrix Migrationstest wurde konfokalmikroskopisch aufgenommen. Die Chemokin-Quelle befindet sich auf der rechten Bildseite. Zeitraffervideo über 16min.
Wanderung von Krebszellen und Ausbildung von Metastasen
Bestimmte Krebszellen stellen den sonst natürlicherweise nur auf Immunzellen vorhandenen Chemokin-Rezeptor CCR7 her. Sie erkennen damit wie Immunzellen die Chemokine CCL19 und CCL21 an ihrer Zelloberfläche und wandern ebenfalls in die Lymphdrüsen und andere Organe des lymphatischen Systems ein, wo sie Metastasen bilden können.
Wir entwickeln im Labor moderne und hochpräzise Methoden zur Erforschung der zellulären Ereignisse, welche nach der Bindung von CCL19 oder CCL21 an ihren Rezeptor ablaufen. Mit diesen Methoden wollen wir herausfinden, welche Signalmoleküle zur Bildung von CCR7 führen, wie ein vom Zielort der Zellwanderung ausgehender Gradient mit einem Konzentrationsgefälle gebildet wird, entlang dessen sich die Zellen zum Ort der höchsten Chemokin-Konzentration fortbewegen, und wie die Zellwanderung reguliert wird. Insbesondere suchen wir Gemeinsamkeiten und Unterschiede im Migrationsverhalten von Krebs- und Immunzellen, was dazu beitragen soll, neue immunologische Therapieansätze zur Verhinderung der CCR7-vermittelten Metastasierung von Tumorzellen zu entwickeln.